- Клинически значимая повышенная чувствительность к устекинумабу или любому вспомогательному веществу препарата;
- Детский возраст до 12 лет (по показанию «бляшечный псориаз»), до 18 лет (по показаниям «псориатический артрит» и «болезнь Крона»);
- Беременность и лактация;
- Серьезные инфекционные заболевания в острой фазе, в том числе туберкулез;
- Злокачественные новообразования.
- Хронические или рецидивирующие паразитарные и инфекционные заболевания вирусной, грибковой или бактериальной природы.
- Злокачественные опухоли в анамнезе.
- Пожилой возраст.
от 138 000 рублей
Стелара: инструкция по применению, аналоги, отзывы, цена
Латинское название: Stelara
Действующее вещество/Аналог: Устекинумаб
Код АТХ: L04AC Ингибиторы интерлейкина
Производитель: Джонсон & Джонсон
Рецептурное: Да
Предназначение: Противогрибковые Противопсориазные
Оцените материал:
Международное непатентованное название (МНН): Устекинумаб
Регистрационный номер: ЛСР-006465/09
Состав
Один флакон Стелара содержит:
Действуюшее вещество: 45 мг (45 мг/0,5 мл) или 90 мг (90 мг/1,0 мл) устекинумаба.
Вспомогательные вещества: сахароза, L-гистидин (в том числе L-гистидина гидрохлорида моногидрат), полисорбат 80, вода для инъекций.
Форма Стелара
Раствор для подкожного введения
Описание лекарственной формы
Описание Прозрачный или слегка опалесцирующий раствор от бесцветного до светло-желтого цвета. Раствор может содержать единичные прозрачные частицы белка.
Классификация
Фармакотерапевтическая группа – иммуносупрессоры, ингибиторы интерлейкина
Код АТХ – L04AC05 Ингибиторы интерлейкина
Фармакологические свойства
Фармакодинамика
Механизм действия. Устекинумаб представляет собой полностью человеческое моноклональное антитело IgG1қ, которое специфично связывается с общей единицей белка p40 интерлейкинов (ИЛ) ИЛ-12 и ИЛ-23 человека. Препарат Стелара ингибирует биоактивность ИЛ-12 и ИЛ-23 человека, предотвращая связывание p40 с рецептором ИЛ-12Rβ1, экспрессируемым на поверхности иммунных клеток. Препарат Стелара не связывается с ИЛ-12 или ИЛ-23, которые уже связаны с рецепторами ИЛ-12Rβ1 на поверхности клеток. Таким образом, маловероятно, что препарат Стелара будет способствовать опосредованной комплементом или антителами цитотоксичности в отношении клеток, экспрессирующих рецепторы к ИЛ-12 и/или ИЛ-23. ИЛ-12 и ИЛ-23 представляют собой гетеродимерные цитокины, секретируемые активированными антигенпредставляющими клетками, например, макрофагами и дендритными клетками. ИЛ-12 стимулирует клетки-естественные киллеры (NK) и дифференцировку CD4+ Tклеток до фенотипа Т-хелпера-1 (Th1), а также стимулирует выработку интерферона гамма (ИФНγ). ИЛ-23 индуцирует путь Т-хелперов-17 (Th17) и способствует выработке ИЛ-17A, ИЛ-21, и ИЛ-22. У пациентов с псориазом определятся повышенные уровни ИЛ-12 и ИЛ-23 в коже и крови.
Концентрация ИЛ12/23p40 в сыворотке крови является фактом дифференциации пациентов с псориатическим артритом, что подтверждает участие ИЛ-12 и ИЛ-23 в патогенезе псориатических воспалительных заболеваний. Полиморфизм генов, кодирующих ИЛ-23А, ИЛ23R и ИЛ-12B, определяет предрасположенность к таким заболеваниям. Кроме того, высокий уровень экспрессии ИЛ-12 и ИЛ-23 обнаруживается в поражённой псориазом коже, а опосредованная ИЛ-12 индукция интерферона гамма коррелирует с активностью псориатического процесса.
Чувствительные к ИЛ-23 Т-клетки были обнаружены в энтезах у мышей со смоделированным воспалительным артритом, где ИЛ-23 вызывал воспаление энтезов. Кроме того, имеются доклинические данные, свидетельствующие об участии ИЛ-23 и нисходящих путей в процессах эрозии и разрушения костной ткани посредством повышения экспрессии рецепторного активатора лиганда ядерного фактора κB (RANKL), который активирует остеокласты.
У пациентов с болезнью Крона отмечено повышение уровней ИЛ-12 и ИЛ-23 в кишечнике и лимфатических узлах. Это сопровождается увеличением уровней интерферона и ИЛ-17A в сыворотке, указывая, что ИЛ-12 и ИЛ-23 способствуют активации Th1 и Th17 при болезни Крона. Кроме того, как ИЛ-12, так и ИЛ-23 могут стимулировать выработку Т-клетками ФНО-α, что приводит к хроническому воспалению кишечника и повреждению эпителиальных клеток. Была обнаружена достоверная взаимосвязь между болезнью Крона и генетическим полиморфизмом генов ИЛ23R и ИЛ12B, что указывает на потенциальную причинную роль сигнальной системы ИЛ-12/23 в развитии заболевания.
Это подтверждается доклиническими данными, свидетельствующими, что активация сигнального пути ИЛ-12/23 необходима для развития повреждения кишечника у мышей со смоделированным воспалительным поражением кишечника. Связывая общую субъединицу p40 ИЛ-12 и ИЛ-23, препарат Стелара может влиять на клиническое течение псориаза, псориатического артрита и болезни Крона посредством прерывания пути выработки цитокинов Th1 и Th17, которые играют центральную роль в патогенезе этих заболеваний.
У пациентов с псориазом и/или псориатическим артритом при терапии препаратом Стелара не отмечалось очевидного влияния на относительное количество популяций циркулирующих иммунных клеток, в том числе субпопуляции Т-клеток памяти и неактивированных Т-клеток, или уровни циркулирующих цитокинов.
В исследованиях, проведенных у пациентов с псориазом и псориатическим артритом, клинический ответ (улучшение оценок по PASI и ACR соответственно), по-видимому, был взаимосвязан с концентрацией устекинумаба в сыворотке. У пациентов с псориазом с лучшим клиническим ответом по шкале PASI средняя концентрация устекинумаба в сыворотке крови была выше, чем у пациентов с менее выраженным клиническим ответом. Доля пациентов, у которых на 28-ой неделе терапии был достигнут ответ PASI 75, увеличивалась по мере увеличения концентрации устекинумаба в сыворотке. Доля пациентов, у которых были достигнуты оценки ACR 20 и ACR 50, увеличивалась по мере увеличения концентрации устекинумаба в сыворотке крови.
У пациентов с болезнью Крона в результате терапии препаратом Стелара отмечалось значимое снижение уровней маркеров воспаления, в том числе С-реактивного белка (CRP) и фекального кальпротектина. У пациентов, получавших препарат Стелара® в течение 44 недель, по сравнению с группой плацебо достигалось и сохранялось снижение в сыворотке крови концентраций ИФНγ и ИЛ-17А, являющихся провоспалительными цитокинами, регулируемыми ИЛ-12 и ИЛ-23.
Иммунизация. Во время долгосрочного клинического исследования III фазы (PHOENIX 2), у пациентов с псориазом, получавших препарат Стелара в течение, по крайней мере, 3,5 лет, наблюдался иммунный ответ на полисахаридную пневмококковую и противостолбнячную вакцину, схожий с таковым в контрольной группе пациентов, получавших несистемную терапию псориаза. У примерно одинакового относительного числа (%) пациентов, получающих лечение препаратом Стелара, и пациентов из контрольной группы достигалась защитная концентрация противопневмококковых и противостолбнячных антител.
Фармакокинетика
Всасывание. Медиана времени до достижения максимальной концентрации устекинумаба в сыворотке крови (tmax) у здоровых лиц составила 8,5 дней после его однократного подкожного введения в дозе 90 мг. Медианы показателя tmax устекинумаба после его однократного подкожного введения в дозе 45 мг или 90 мг у пациентов с псориазом были сравнимы с таковыми, отмечаемыми у здоровых добровольцев. Абсолютная биодоступность устекинумаба после его однократного подкожного введения пациентам с псориазом составляет оценивается равной 57,2%.
Распределение. Среднее значение объема распределения устекинумаба у пациентов с псориазом в терминальной фазе выведения (Vz) после однократного внутривенного введения составляла от 57 до 83 мл/кг.
Метаболизм. Метаболический путь устекинумаба не известен.
Выведение. Медиана системного клиренса (CL) устекинумаба у пациентов с псориазом после однократного внутривенного введения составляла от 1,99 до 2,34 мл/сут/кг. В ходе клинических исследований период полувыведения (T1/2) устекинумаба у пациентов с болезнью Крона, псориазом и/или псориатическим артритом находился в диапазоне от 15 до 32 дней, а его медиана составила около 3-х недель.
Линейность дозы. Системная экспозиция устекинумаба (Cmax и AUC) после однократного внутривенного введения в дозе от 0,09 мг/кг до 4,5 мг/кг или после однократного подкожного введения в дозе от приблизительно 24 мг и до 240 мг у пациентов с псориазом возрастала примерно пропорционально введенной дозе.
Фармакокинетика после однократного и многократного введения
Профили изменения концентрации устекинумаба в плазме крови с течением времени после однократного или многократного подкожного введения в целом были предсказуемы. Равновесная концентрации устекинумаба в плазме крови у пациентов с псориазом достигалась к 28-ой неделе. после первого подкожного введения и на 0-ой и 4-ой неделях при последующих введениях каждые 12 недель. Медиана наименьших равновесных концентраций находилась в диапазоне от 0,21 мкг/мл до 0,26 мкг/мл (при введении в дозе 45 мг) и от 0,47 мкг/мл до 0,49 мкг/мл (при введении в дозе 90 мг). Также не наблюдалось признаков кумуляции устекинумаба в плазме крови с течением времени при подкожном введении с частотой 1 раз в 12 недель. У пациентов с болезнью Крона после внутривенного ведения в рекомендованной инициирующей дозе медиана максимальной концентрации устекинумаба составила 126,1 мкг/мл. Начиная с 8-ой недели, подкожное введение поддерживающей дозы устекинумаба, составляющей 90 мг, проводилось каждые 8 или 12 недель. Равновесная концентрация устекинумаба достигалась к моменту введения второй поддерживающей дозы. Медиана наименьших равновесных концентраций устекинумаба при введении в дозе 90 мг каждые 8 или 12 недель находилась в диапазоне от 1,97 мкг/мл до 2,24 мкг/мл и от 0,61 мкг/мл до 0,76 мкг/мл соответственно. На фоне наименьших равновесных концентраций устекинумаба, достигавшихся при его введении в дозе 90 мг с частотой 1 раз каждые 8 недель, отмечались более высокие показатели клинической ремиссии, чем при наименьших равновеных концентрациях, достигавшихся после введения устекинумаба в дозе 90 мг с частотой 1 раз каждые 12 недель.
Влияние массы тела на фармакокинетику
У пациентов с псориазом или псориатическим артритом концентрация устекинумаба в плазме крови изменялась в зависимости от массы тела. При применении в любой из доз (45 мг или 90 мг) у пациентов с более высокой массой тела (>100 кг) отмечалась более низкая медиана концентрации устекинумаба по сравнению с пациентами с более низкой массой тела (≤100 кг). Однако при сравнении разных доз медиана наименьших концентраций устекинумаба в плазме крови у пациентов с более высокой массой тела (>100 кг) при дозе 90 мг была сравнима с таковой у пациентов с более низкой массой тела (≤100 кг) при дозе 45 мг.
Популяционный фармакокинетический анализ
В ходе популяционного фармакокинетического анализа с использованием данных, полученных у пациентов с псориазом, кажущийся клиренс (CL/F) и кажущийся объем распределения (V/F) составили 0,465 л/сут и 15,7 л соответственно, а T1/2 у пациентов с псориазом составил около 3-х недель. Кажущийся клиренс устекинумаба не зависел от пола, возраста или расы. Он зависел от массы тела, при этом отмечалась тенденция к более высоким показателям кажущегося клиренса у пациентов с более высокой массой тела. Медиана кажущегося клиренса у пациентов с массой тела >100 кг была приблизительно на 55% выше, чем у пациентов с массой тела ≤100 кг. Медиана кажущегося объема распределения у пациентов с массой тела >100 кг была приблизительно на 37% выше, чем у пациентов с массой тела ≤100 кг. Аналогичные результаты были получены и в результате подтверждающего популяционного фармакокинетического анализа, проводившегося по данным, полученным для пациентов с псориатическим артритом.
В ходе популяционного фармакокинетического анализа у пациентов с псориазом была проведена оценка влияния сопутствующих заболеваний (сахарный диабет, артериальная гипертензия и гиперлипидемия) на фармакокинетику устекинумаба. На нее оказывало влияние наличие сахарного диабета, при этом у пациентов с сахарным диабетом отмечалась тенденция к более высоким показателям кажущегося клиренса. Средние показатели кажущегося клиренса у
пациентов с сахарным диабетом были приблизительно на 29% выше, чем у пациентов без сахарного диабета.
Популяционный фармакокинетический анализ установил наличие тенденции к более высоким показателям клиренса устекинумаба у пациентов с положительным иммунным ответом. Специальных исследований лекарственных взаимодействий у здоровых лиц или у пациентов с псориазом, псориатическим артритом или болезнью Крона, не проводилось. В ходе популяционного фармакокинетического анализа было изучено влияние лекарственных препаратов, наиболее часто применяемых у пациентов с псориазом (в том числе парацетамола/ ацетаминофена ибупрофена, ацетилсалициловой кислоты, метформина, аторвастатина, напроксена, левотироксина, гидрохлортиазида и противогриппозной вакцины), на фармакокинетику устекинумаба. Было установлено, что ни один их этих препаратов не оказывает значимого влияния. Фармакокинетика устекинумаба не изменялась в результате предшествовавшего применения метотрексата, циклоспорина или других биологических препаратов для терапии псориаза. У пациентов с псориатическим артритом или болезнью Крона фармакокинетика устекинумаба не изменялась при одновременном применении с метотрексатом, нестероидными противовоспалительными лекарственными средствами, пероральными кортикостероидами, 6-меркаптопурином, азатиоприном, или в результате предшествующего применения препаратов, блокирующих ФНО-α.
Эффекты ИЛ-12 или ИЛ-23 в отношении регуляции активности изоферментов CYP450 были изучены в ходе исследования in vitro с применением гепатоцитов человека. В результате было установлено, что ИЛ-12 и/или ИЛ-23 при концентрации 10 нг/мл не влияют на активность изоферментов CYР450 (CYP1A2, 2B6, 2C9, 2C19, 2D6 или 3A4).
Фармакокинетика особых групп пациентов
Дети (в возрасте от 12 до 18 лет)
Фармакокинетика устекинумаба у детей в возрасте от 12 до 18 лет, с псориазом, получавших рекомендованную дозу, в целом была сравнима с фармакокинетикой у взрослых пациентов с псориазом. Пожилые пациенты (в возрасте от 65 лет и старше) Исследования фармакокинетики у пациентов пожилого возраста не проводилось.
Популяционный фармакокинетический анализ среди пациентов старше 65 лет не выявил влияния возраста на величины кажущегося клиренса (CL/F) и объема распределения (V/F). Пациенты с нарушением функции почек Данные о фармакокинетике препарата у пациентов с нарушением функции почек отсутствуют. Пациенты с нарушением функции печени Данные о фармакокинетике препарата у пациентов с нарушением функции печени отсутствуют. Другие группы пациентов Фармакокинетика устекинумаба сравнима у пациентов азиатского происхождения с псориазом и у пациентов неазиатского происхождения с псориазом. Употребление алкоголя или табака не влияло на фармакокинетику устекинумаба.
Показания препарата Стелара
Бляшечный псориаз
Лечение взрослых пациентов и детей от 12 до 18 лет со средней или тяжелой степенью бляшечного псориаза при отсутствии эффекта от лечения или при наличии противопоказаний, или при непереносимости других методов системной терапии или фототерапии.
Псориатический артрит
Лечение пациентов старше 18 лет с активным псориатическим артритом (ПсА) в качестве монотерапии или в комбинации с метотрексатом.
Болезнь Крона
Препарат Стелара предназначен для: - индукции и поддержания клинического ответа - индукции и поддержания клинической ремиссии - достижения бесстероидной ремиссии - индукции эндоскопической ремиссии - улучшения связанного со здоровьем качества жизни у взрослых пациентов с активной болезнью Крона средней или тяжелой степени, у которых: - прогрессирование заболевания продолжалось на фоне терапии иммуномодуляторами или кортикостероидами, или была выявлена непереносимость этих препаратов, или - наблюдалась зависимость от кортикостероидов, или - прогрессирование заболевания продолжалось на фоне терапии одним или несколькими ингибиторами ФНО, или была выявлена непереносимость одного или нескольких ингибиторов ФНО.
Противопоказания
Стелара с осторожностью
Применение Стелара при беременности
Беременность. В исследованиях на животных не было получено доказательств тератогенности, врожденных дефектов или задержек развития при применении доз, примерно в 45 раз превышающих самую высокую эквивалентную дозу, предназначенную для применения у пациентов с псориазом. Тем не менее, исследования влияния устекинумаба на репродуктивную функцию и на развитие потомства у животных не всегда прогнозируют реакции, развивающиеся у человека. Неизвестно, может ли применение препарата Стелара нанести вред плоду при применении у беременных женщин или повлиять на репродуктивную функцию. Препарат Стелара следует применять у беременных женщин только в случае, если ожидаемая польза от применения у матери перевешивает потенциальный риск для плода.
Период грудного вскармливания. Выделение препарата Стелара с грудным молоком наблюдалось у обезьян. Неизвестно, абсорбируется ли препарат Стелара системно после приема внутрь. Поскольку многие препараты и иммуноглобулины выделяются с грудным молоком у человека и в связи с возможностью возникновения нежелательных явлений у детей, получающих грудное молоко, следует принять решение о прекращении грудного вскармливания в период приема препарата или об отмене терапии устекинумабом.
Планирование беременности при приеме Стелара
Оценка влияния препарата Стелара на фертильность человека не проводилась. В исследовании фертильности, проведенном у мышей, не было выявлено неблагоприятных эффектов в отношении фертильности самок.
Стелара, инструкция по применению
Оптимальный режим дозирования определяет лечащий врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Согласно действующей инструкции лекарственное средство Стелара предназначено для приема по следующей схеме:
в лекарственной форме «раствор для подкожного введения» предназначен для подкожных инъекций.
Взрослые пациенты
Бляшечный псориаз
Рекомендованная доза составляет 45 мг. Вторую инъекцию делают 4 недели спустя после первого применения, затем каждые 12 недель. У пациентов с массой тела более 100 кг препарат рекомендуется использовать в дозе 90 мг.
При неэффективности терапии в течение 28 недель рекомендуется рассмотреть целесообразность применения препарата.
Коррекция дозы
Пациентам, у которых клиническая эффективность препарата при применении каждые 12 недель выражена недостаточно, следует увеличить дозу препарата до 90 мг каждые 12 недель. В случае если такой режим дозирования не эффективен, дозу препарата 90 мг следует вводить каждые 8 недель. Возобновление лечения Было показано, что возобновление терапии по схеме: вторая инъекция через 4 недели спустя после первого применения, а затем каждые 12 недель, является эффективным и безопасным.
Псориатический артрит
Рекомендованная доза составляет 45 мг. Вторую инъекцию делают 4 недели спустя после первого применения, затем каждые 12 недель. У пациентов с массой тела более 100 кг препарат рекомендуется использовать в дозе 90 мг.
Болезнь Крона
Пациентам с болезнью Крона рекомендовано однократное, инициирующее терапию внутривенное введение препарата Стелара в лекарственной форме «концентрат для приготовления раствора для инфузий» в дозе, рассчитанной на основании массы тела, с последующим подкожным введением дозы 90 мг через 8 недель (первое подкожное введение) и 1 раз каждые 12 недель в дальнейшем. Подробная информация о внутривенном введении препарата Стелара® указана в инструкции по медицинскому применению препарата Стелара® , концентрат для приготовления раствора для инфузий.
Пациенты, у которых через 8 недель после первого подкожного введения не удалось получить достаточный ответ, в это время могут получить вторую подкожную инъекцию. У пациентов с потерей ответа при введении 1 раз в 12 недель положительный результат может получен при увеличении частоты введений до 1-го раза в 8 недель. В дальнейшем препарат пациентам можно вводить 1 раз в 8 недель или 1 раз в 12 недель, в зависимости от клинической ситуации.
Во время терапии препаратом Стелара можно продолжать терапию иммуномодуляторами и/или кортикостероидами.
Пациентам, у которых удалось добиться ответа на терапию препаратом Стелара, терапию кортикостероидами можно сократить или отменить, в соответствии со стандартами терапии. При прерывании терапии возобновление ее посредством подкожных инъекций каждые 8 недель является безопасным и эффективным.
Стелара детям
Бляшечный псориаз Рекомендованная доза зависит от массы тела пациента, как показано в таблице 1. Вторую инъекцию делают 4 недели спустя после первого применения, затем каждые 12 недель.
Таблица 1. Рекомендованная доза препарата Стелара у детей с бляшечным псориазом
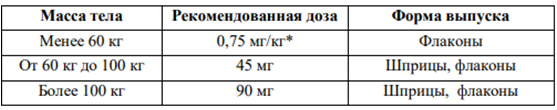 - для расчета необходимого объема препарата (мл) для пациентов с массой тела менее 60 кг используется следующая формула: масса тела (кг) × 0,0083 (мл/кг). Рассчитанный объем препарата округляется до сотой доли мл (0,01 мл). Инъекция осуществляется градуированным шприцем вместимостью 1 мл. Для пациентов, которым необходима доза менее 45 мг, препарат Стелара выпускается во флаконах с дозировкой 45 мг.
- для расчета необходимого объема препарата (мл) для пациентов с массой тела менее 60 кг используется следующая формула: масса тела (кг) × 0,0083 (мл/кг). Рассчитанный объем препарата округляется до сотой доли мл (0,01 мл). Инъекция осуществляется градуированным шприцем вместимостью 1 мл. Для пациентов, которым необходима доза менее 45 мг, препарат Стелара выпускается во флаконах с дозировкой 45 мг. Детям препарат применяется в условиях стационара.
При неэффективности терапии в течение 28 недель рекомендуется рассмотреть целесообразность применения препарата.
Особые группы пациентов
Дети
Исследования препарата Стелара у детей младше 12 лет не проводились. Пожилые пациенты В клинических исследованиях не наблюдалось существенных возрастных различий клиренса или объема распределения препарата.
Количество пациентов в возрасте от 65 лет и старше было недостаточным для окончательного вывода о влиянии возраста на клиническую эффективность препарата.
Пациенты с нарушением функции почек
У пациентов с почечной недостаточностью не проводилось отдельных исследований препарата.
Пациенты с нарушением функции печени
У пациентов с печеночной недостаточностью не проводилось отдельных исследований препарата.
Указания по введению препарата
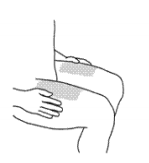
Препарат предназначен для подкожного введения. Препарат не следует смешивать с другими жидкостями для инъекции. Если для введения дозы 90 мг используют 2 флакона по 45 мг препарата, следует сделать 2 последовательные инъекции. При этом вторая инъекция должна быть сделана сразу же после первой. Инъекции следует делать в разные области. Не встряхивайте препарат. Длительное энергичное встряхивание может повредить препарат. Не используйте препарат, если его встряхивали. В начале лечения инъекции препарата Стелара должен делать только медицинский персонал, однако, в последующем, если врач сочтет это возможным, пациент может делать себе инъекции препарата Стелара самостоятельно, соблюдая все необходимые предосторожности и пройдя предварительно обязательное обучение технике подкожных инъекций, с последующим контролем врача. У детей в возрасте от 12 до 18 лет все инъекции должны проводиться медицинским персоналом. Рекомендованными местами для инъекции являются верхняя часть бедра или область живота примерно 5 см ниже пупка.
Также можно использовать область плеча (см. Рис 1).
Следует избегать инъекций в область, пораженную псориазом.
 Перед введением препарата внимательно осмотрите содержимое флакона. Раствор должен быть опалесцирующим от бесцветного до светло-желтого цвета, может содержать единичные прозрачные частицы белка. При изменении цвета, помутнении или наличии твердых частиц раствор использовать нельзя. Тщательно вымойте руки и обработайте место инъекции ватным тампоном, смоченным антисептиком.
Перед введением препарата внимательно осмотрите содержимое флакона. Раствор должен быть опалесцирующим от бесцветного до светло-желтого цвета, может содержать единичные прозрачные частицы белка. При изменении цвета, помутнении или наличии твердых частиц раствор использовать нельзя. Тщательно вымойте руки и обработайте место инъекции ватным тампоном, смоченным антисептиком. Рис. 2
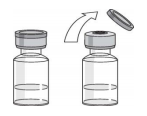
Снимите защитный колпачок с флакона с препаратом (Рис. 2). Не снимайте резиновый колпачок. Протрите резиновый колпачок ватным тампоном, смоченным антисептиком. Снимите защитный колпачок с иголки шприца (шприц не входит в комплект упаковки препарата). Не допускайте контакта иголки с посторонними предметами и не трогайте иголку. Поставьте флакон с препаратом на ровную поверхность и воткните иглу шприца в резиновый колпачок флакона. Переверните флакон с препаратом и воткнутым в него шприцом как это показано на рисунке 3.
Рис. 3
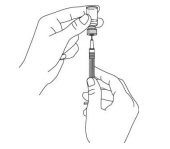
Для введения взрослым пациентам или детям в возрасте от 12 до 18 лет с массой тела более 60 кг, наберите всё содержимое флакона в шприц. Объем препарата для введения детям в возрасте от 12 до 18 лет с массой тела менее 60 кг должен быть предварительно рассчитан медицинским персоналом. Во избежание попадания пузырьков воздуха в шприц, кончик иглы, пока вы набираете препарат в шприц, всегда должен находиться в жидкости. Выньте шприц из флакона. Держите шприц иголкой в направлении от себя и проверьте наличие в нем пузырьков воздуха. При наличии пузырьков воздуха в шприце осторожно постучите по стенке шприца, пока пузырьки воздуха не переместятся вверх (Рис.4).
Рис.4
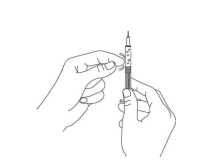
Надавите на поршень шприца, чтобы выпустить пузырьки воздуха. Не кладите шприц и не допускайте контакта иглы с посторонними предметами. Аккуратно зажмите кожу в области инъекции между большим и указательным пальцами, воткните иголку в кожу и медленно опустите поршень шприца до предела (Рис.5).
Рис. 5
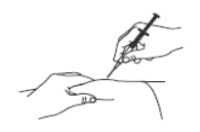
После этого отпустите кожу и осторожно выньте иглу. Из места инъекции может выделиться небольшое количество крови. Это нормально. Приложите ватный тампон, смоченный антисептиком, к месту инъекции и подержите несколько секунд. Не трите место инъекции. При необходимости заклейте пластырем. Неиспользованное количество препарата должно быть уничтожено. Использованный шприц, иглу и флакон необходимо утилизировать в соответствии с местными требованиями по уничтожению такого рода отходов. Повторное использование шприца, иглы или флакона запрещено. Флаконы могут быть выброшены с обычным мусором.
Побочные действия
В этом разделе представлены данные о побочных действиях. Побочные действия − это нежелательные явления, которые были расценены как обоснованно связанные с использованием устекинумаба на основании всесторонней оценки имеющихся данных о нежелательных явлениях. В отдельных случаях не представляется возможным достоверно установить наличие причинной связи между нежелательным явлением и применением устекинумаба. Кроме того, поскольку клинические исследования проводятся в разных условиях, невозможно провести непосредственное сравнение частоты нежелательных реакций, наблюдаемых в клиническом исследовании препарата, с частотой, наблюдаемой в клинических исследованиях другого препарата, и частота нежелательного явления, наблюдаемая в клиническом исследовании, может не соответствовать частоте, наблюдаемой в клинической практике.
Опыт применения в клинических исследованиях у взрослых пациентов с псориазом, псориатическим артритом и болезнью Крона.
Данные по безопасности, представленные далее, отражают применение препарата Стелара® в 12 исследованиях II фазы и III фазы, проведенных у 5884 пациентов (4135 пациентов с псориазом и/или псориатическим артритом и 1749 пациентов с болезнью Крона). Наиболее частыми (>5%) побочными действиями, наблюдавшимися в контролируемых периодах клинических исследований препаратом Стелара® , проведенных у пациентов с псориазом, псориатическим артритом и болезнью Крона, были назофарингит и головная боль. Большинство случаев были расценены как легкие и не требующие прекращения терапии. Общий профиль безопасности препарата Стелара® был схожим у пациентов с псориазом, псориатическим артритом и болезнью Крона. У пациентов с болезнью Крона, получавших терапию устекинумабом в течение 2-х лет, не было обнаружено каких-либо отличающихся данных по безопасности. Расчет частоты этих побочных действий проводился на основании случаев, зарегистрированных во время начальных контролируемых периодов клинических исследований.
Побочные действия расположены в порядке уменьшения частоты, в соответствии со следующими категориями: Очень часто (≥1/10) Часто (≥1/100, <1/10) Нечасто (≥1/1000, <1/100) Редко (≥1/10000, <1/1000)
Со стороны нервной системы: часто - головокружение, головная боль, депрессия.
Со стороны дыхательной системы: часто - боль в горле и гортани, заложенность носа.
Со стороны пищеварительной системы: часто - диарея.
Со стороны кожи и подкожных тканей: часто - зуд.
Со стороны костно-мышечной системы: часто - миалгия, боль в спине.
Аллергические реакции: <2% - сыпь и крапивница.
Иммуногенность: 5% - формирование антител к устекинумабу, которые обычно имели низкий титр.
Общие реакции: часто - усталость.
Злокачественные новообразования: в клинических плацебо-контролируемых исследованиях у больных с псориазом и псориатическим артритом частота развития злокачественных опухолей (не включая немеланомную форму рака кожи) в группах, получавших устекинумаб и плацебо, составляла соответственно 0.16 (1/615) и 0.35 (1/287) случая на 100 человек/год. Частота развития иных, чем меланома, форм рака кожи при применении устекинумаба и плацебо составляла соответственно 0.65 (4/615) и 0.70 (2/287) случая на 100 человек/год. Частота развития злокачественных опухолей у пациентов, получавших устекинумаб, была сравнима с частотой возникновения опухолей среди населения в целом. Наиболее часто, помимо немеланомного рака кожи, наблюдались злокачественные опухоли простаты, кишечника, молочной железы и меланома. Частота развития немеланомного рака кожи у пациентов, получавших устекинумаб, составляла 0.61 случаев на 100 человек/год (41/6770).
Местные реакции: часто - усталость; иногда - реакции в месте введения (боль, припухлость, зуд, уплотнение, кровотечение, кровоизлияния, раздражение).
Передозировка
При однократных внутривенных введениях доз до 6 мг/кг в рамках клинических исследований не отмечалось токсичности, ограничивающей дозу. В случае передозировки рекомендуется наблюдать пациента на предмет любых признаков и проявлений нежелательных реакций с целью немедленного начала соответствующей симптоматической терапии.
Взаимодействие
Исследования лекарственных взаимодействий с препаратом Стелара у человека не проводились. Эффекты ИЛ-12 или ИЛ-23 на регуляцию изоферментов CYP450 оценивались in vitro с использованием гепатоцитов человека. В исследовании было показано, что ИЛ-12 и/или ИЛ-23 в концентрации 10 нг/мл не влияют на активность изоферментов CYP450 человека (CYP1А2, 2В6, 2С9, 2С19, 2D6 или 3А4). Полученные результаты не предполагают необходимости коррекции дозы у пациентов, принимающих одновременно с препаратом Cтелара препараты, метаболизируемые изоферментами CYP450. Живые вакцины не следует вводить одновременно с применением препарата Стелара. При совместном применении препарата Cтелара и таких препаратов, как парацетамол (ацетаминофен), ибупрофен, ацетилсалициловая кислота, метформин, аторвастатин, напроксен, левотироксин и гидрохлоротиазид взаимодействия не было выявлено. Безопасность и эффективность совместного применения препарата Cтелара с другими иммунодепрессантами (метотрексат, циклоспорин) или биологическими препаратами для лечения псориаза не была оценена.
Особые указания
Инфекции
Препарат Стелара является селективным иммунодепрессантом, и потенциально может увеличивать риск возникновения инфекций и реактивации латентных инфекций. В ходе клинических исследований у пациентов, получавших препарат Стелара, наблюдались случаи возникновения серьезных бактериальных и вирусных инфекций. Препарат Стелара не следует применять у пациентов с клинически значимой активной инфекцией. Следует с осторожностью применять препарат Стелара у пациентов с хронической инфекцией или рецидивирующей инфекцией в анамнезе. Перед началом терапии препаратом Стелара следует обследовать пациентов на наличие туберкулеза.
Препарат Стелара не следует применять у пациентов с активным туберкулезом. Перед применением препарата Стелара следует провести терапию латентного туберкулеза. Кроме того, противотуберкулезную терапию перед началом применения препарата Стелара® следует провести пациентам с латентным или активным туберкулезом в анамнезе, для которых отсутствует подтверждение проведения эффективного курса лечения.
У пациентов, получающих препарат Стелара, во время и после терапии следует внимательно контролировать признаки или симптомы активного туберкулеза. Пациентов следует проинструктировать о необходимости обращения за медицинской помощью в случае появления признаков или симптомов, указывающих на развитие инфекции. В случае, если у пациента развивается серьезная инфекция, необходимо проводить тщательное наблюдение пациента и не применять препарат Стелара® до разрешения инфекционного процесса.
Злокачественные новообразования
Препарат Стелара является селективным иммунодепрессантом. Препараты-иммунодепрессанты могут способствовать увеличению риска развития злокачественных новообразований. У некоторых пациентов, получавших препарат Стелара в рамках клинических исследований, наблюдалось развитие кожных и некожных злокачественных новообразований. Применение препарата Стелара не изучалось у пациентов со злокачественными новообразованиями в анамнезе. Следует проявлять осторожность при назначении препарата Стелара пациентам со злокачественными новообразованиями в анамнезе, а также при рассмотрении возможности продолжения терапии препаратом Стелара у пациентов с диагностированными злокачественными новообразованиями. У всех пациентов, особенно у пациентов в возрасте старше 60 лет и у пациентов, ранее получавших длительную терапию иммунодепрессантами или ПУВА-терапию, необходимо проводить обследование на наличие немеланомного рака кожи.
Реакции гиперчувствительности
В ходе пострегистрационного наблюдения были зарегистрированы серьезные реакции гиперчувствительности, включая анафилаксию и ангионевротический отек. В случае развития анафилактических или других серьезных реакций гиперчувствительности следует начать соответствующую терапию и прекратить применение препарата Стелара.
Вакцинация
Не рекомендуется применять живые вирусные или живые бактериальные вакцины одновременно с препаратом Стелара. Данные о вторичном инфицировании при применении живых вакцин у пациентов, получающих препарат Стелара, отсутствуют. Следует соблюдать осторожность при применении живых вакцин для иммунизации членов семьи пациента, получающего лечение препаратом Стелара, поскольку имеется риск вирусо- или бактериовыделения и передачи инфекции от этих лиц пациентам. Пациентам, получающим препарат Стелара, можно одновременно вводить инактивированные или неживые вакцины. Длительное лечение препаратом Стелара не подавляет гуморальный иммунный ответ на вакцины, содержащие пневмококковый полисахарид и противостолбнячную вакцину.
Сопутствующая иммуносупрессивная терапия
Безопасность и эффективность препарата Cтелара при применении в комбинации с иммунодепрессантами или фототерапией не изучалась в исследованиях у пациентов с псориазом. В исследованиях у пациентов с псориатическим артритом одновременное применение метотрексата не влияло на безопасность и эффективность препарата Стелара® . В исследованиях у пациентов с болезнью Крона совместное применение препарата Стелара с иммуномодуляторами (6-меркаптопурином, азатиоприном, метотрексатом) или с кортикостероидами не влияло на безопасность и эффективность препарата Стелара. Следует проявлять осторожность при рассмотрении возможности одновременного применения иммунодепрессантов и устекинумаба, а также при переходе с терапии другими биологическими препаратами на терапию устекинумабом.
Иммунотерапия
Безопасность и эффективность применения препарата Cтелара у пациентов, прошедших иммунотерапию аллергических заболеваний, не установлена. Препарат Стелара может оказывать влияние на иммунотерапию аллергических заболеваний. Следует соблюдать осторожностью при применении устекинумаба у пациентов, получающих или ранее получавших иммунотерапию аллергических заболеваний, особенно если такая терапия связана с анафилаксией.
Влияние Стелара на управление автомобилем
Исследований не проводилось.
Форма выпуска
Раствор для подкожного введения. Каждый флакон содержит 45 мг (45 мг/0,5 мл) или 90 мг (90 мг/1,0 мл) устекинумаба. По 0,5 мл или 1,0 мл во флаконы из боросиликатного стекла (тип I), вместимостью 2 мл, укупоренные резиновой пробкой, обжатой алюминиевым колпачком, и снабженные крышкой типа flip-off. По 1 флакону вместе с инструкцией по медицинскому применению помещают в пачку картонную.
Условия хранения Стелара
Хранить в оригинальной упаковке в защищенном от света месте при температуре от 2 до 8 оС. Не замораживать. Не встряхивать. Хранить в недоступном для детей месте.
Срок годности Стелара
2 года. Не использовать после истечения срока годности.
Условия продажи
Отпускают по рецепту.
Производитель Стелара
Силаг АГ, Хохштрассе 201, 8200 Шаффхаузен, Швейцария.
Цена Стелара, где купить?
Цена Стелара в аптеках: от 180 000 рублей до 238 000 рублей
Организация, принимающая претензии по препарату: Стелара
ИНФОРМИРУЙТЕ ВРАЧА О ПОЯВЛЕНИИ У ВАС ЛЮБЫХ, В ТОМ ЧИСЛЕ НЕ УПОМЯНУТЫХ В ДАННОЙ ИНСТРУКЦИИ, НЕЖЕЛАТЕЛЬНЫХ РЕАКЦИЯХ И ОЩУЩЕНИЯХ! А ТАКЖЕ ОБ ИЗМЕНЕНИИ ЛАБОРАТОРНЫХ ПОКАЗАТЕЛЕЙ НА ФОНЕ ПРИЕМА ЛЕКАРСТВЕННОГО СРЕДСТВА!

